代办二类体外诊断试剂进口注册
- 立即咨询
-
全国服务热线:
139-2227-8819
♛ 办理条件 / Conditions
申请人应为境外生产企业,且该医疗器械已在注册申请人注册地或者生产地址所在国家(地区)已获准上市销售。
۞ 申请材料清单 / List of application materials
|
1、申请表 2、证明性文件 3、3符合性声明 4、综述资料 5、主要原材料的研究资料 6、主要生产工艺及反应体系的研究资料 7、分析性能评估资料 8、阳性判断值或参考区间确定资料
|
9、稳定性研究资料 10、生产及自检记录 11、临床评价资料 12、产品风险分析资料 13、产品技术要求 14、产品注册检验报告 15、产品说明书 16、标签样稿 |
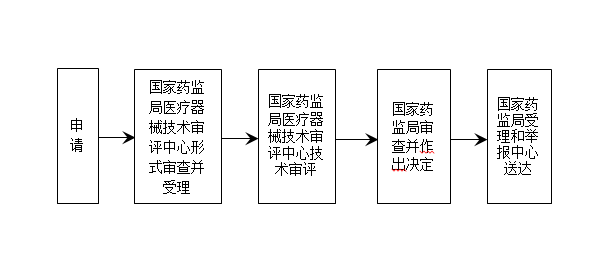
㉿ 办理流程 / Processing process
✪ 办理依据 / Processing basis
|
法律法规名称:《医疗器械监督管理条例》 依据文号:(国务院令第650号)第十一条:申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。申请第三类医疗器械产品注册,注册申请人应当向国务院食品药品监督管理部门提交注册申请资料。 |
向我国境内出口第二类、第三类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。第二类、第三类医疗器械产品注册申请资料中的产品检验报告应当是医疗器械检验机构出具的检验报告;临床评价资料应当包括临床试验报告,但依照本条例第十七条的规定免于进行临床试验的医疗器械除外。 |