二类创新医疗器械特别审批
- 立即咨询
-
全国服务热线:
139-2227-8819
♛ 办理条件 / Conditions
1.企业注册地在广东省内;
2.符合食药监办械注〔2015〕511号文中第四条要求,且能提供食药监办械注〔2015〕511号文中第五条材料的。
۞ 申请材料清单 / List of application materials
|
1.广东省创新医疗器械特别审批申请表 2.申请人企业法人资格证明文件(可通过系统自动获取) 3.产品知识产权情况及证明文件 4.产品作为第二类医疗器械管理的分类依据 |
5.产品研发过程及结果的综述,产品技术文件 6.产品说明书(样稿) 7.体现临床应用价值的资料 |
㉿ 办理流程 / Processing process
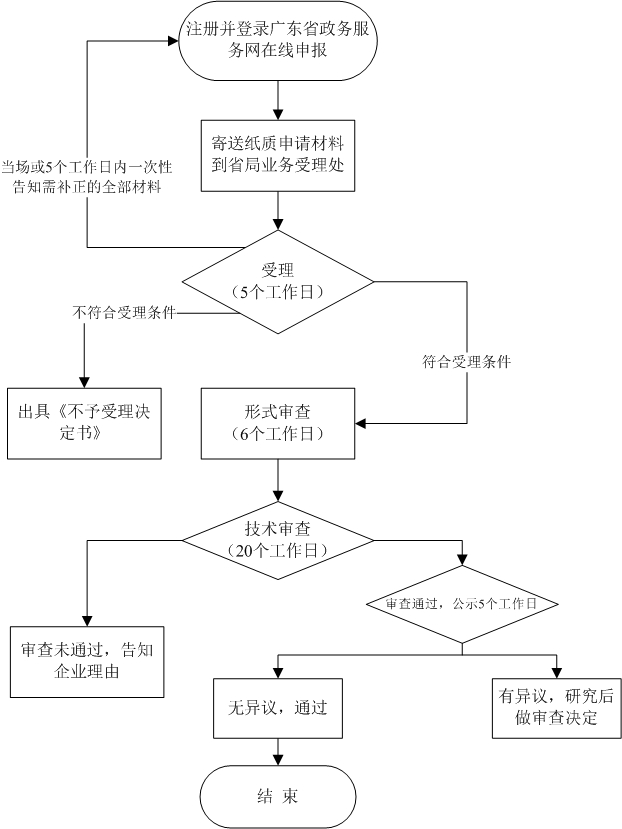
❈ 办理时间 / Processing time
|
名称 |
说明 |
时限 |
|
法定办结时限 |
省药品监督管理局对申报材料是否符合本程序第四条要求进行初审,并于6个工作日内完成初审。初审符合要求的,由省药品监督管理局审评认证中心进行技术审查,在20个工作日内出具审查意见,并将审查意见进行公示。公示内容应包括申请人、产品名称,公示时间不少于5个工作日。对于公示有异议的,应当对相关意见研究后作出最终审查意见。初审不符合要求的,省食品药品监督管理局应当通知申请人。 |
26(工作日) |
|
承诺办结时限 |
|
26(工作日) |
|
到现场次数 |
|
0次 |
✪ 办理依据 / Processing basis
|
1. 法律法规名称:《国家食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知》 依据文号:食药监械管〔2014〕13号第一条 |
2. 法律法规名称:《关于印发广东省第二类创新医疗器械特别审批程序(试行)的通知》 依据文号:食药监办械注〔2015〕511号第四条 |